Von Zeit zu Zeit haben Forscher in der Medizin einfach nur… Glück. In diesem Fall könnte dieser Glücksfall tiefgreifende Auswirkungen auf die Medizin insgesamt haben.
Forscher der Universität Cardiff waren gerade dabei, Blut aus einer Bank zu analysieren, als sie zufällig auf einen „völlig neuen Typ von T-Zellen“stießen. Die neue Zelle trägt einen „noch nie zuvor gesehenen“ Rezeptortyp, der wie ein Greifhaken wirkt und sich bei den meisten Krebsarten des Menschen festkrallt.
Frühere Therapien, CAR-T und TCR-T genannt, die Immunzellen verwenden, um sich an HLA-Moleküle auf der Oberfläche von Krebszellen zu koppeln, sind nicht in der Lage, schwerere Tumore zu bekämpfen, heißt es in dem Artikel. HLA-Moleküle variieren bei Menschen, doch die neue Therapie heftet sich stattdessen an ein Molekül namens MR1 an, das beim Menschen nicht variiert. Dies gibt der Therapie eine Chance, gegen die meisten Krebsarten zu wirken.
Dies bedeutet auch, dass die Patienten die Behandlung mit anderen teilen können, sodass Zellbanken bei Bedarf schnell gespeichert und angeboten werden können.
Die Behandlung hat bereits bei Lungen-, Haut-, Blut-, Dickdarm-, Brust-, Knochen-, Prostata-, Eierstock-, Nieren- und Gebärmutterhalskrebszellen funktioniert.
Die Studie stellte fest:
„Eine vom menschlichen Leukozytenantigen (HLA) unabhängige durch T-Zellen vermittelte Bekämpfung von Krebszellen würde die Immunzerstörung von bösartigen Tumoren bei allen Menschen ermöglichen. Hier verwenden wir das genomweite CRISPR-Cas9-Screening, um zu zeigen, dass ein T-Zellen-Rezeptor die meisten menschlichen Krebsarten über das monomorphe MHC-Klasse-I verwandte Protein MR1 erkennt und tötet, während er gegenüber Nicht-Krebszellen inaktiv bleibt … Diese Erkenntnisse bieten Möglichkeiten für HLA-unabhängige Immuntherapien, die sich auf alle Krebsarten und die gesamte Bevölkerung erstrecken.“
Die Studie folgerte desweiteren:
„Zusammengefasst beschreiben wir einen TCR, der eine Gesamtkrebserkennung über die MR1-Molekülvariante aufweist und durch die Behandlung von Patienten mit Melanom-T-Zellen, denen eine nachweisbare Krebsreaktivität mit dem MC fehlte. Mit 7 G5 TCR haben wir die T-Zellen in die Lage versetzt, körpereigene Melanome abzutöten.“
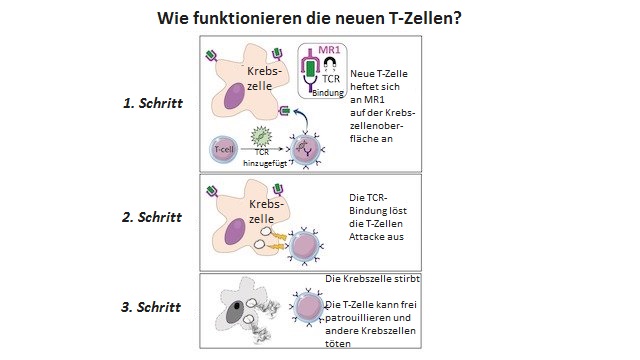
Was heißt das nun?
Es bedeutet, dass es funktioniert. Überdies waren die T-Zellen von Hautkrebspatienten, die durch die Behandlung verändert wurden, in der Lage, die Krebszellen des Patienten und auch die Krebszellen anderer Patienten abzutöten.
Der Hauptautor der Studie, Andrew Sewell, sagte:
„Dies war ein glücklicher Zufall, denn niemand wusste, dass diese Zelle existiert. Unsere Erkenntnisse eröffnen die Aussicht auf eine Art Universal-Krebsbehandlung, d.h. eine einzige Art von T-Zellen, die in der Lage sein könnte, viele verschiedene Krebsarten in der gesamten Bevölkerung zu zerstören. Bislang hatte niemand dies für möglich gehalten.“
„Diese neue Art der T-Zelltherapie hat ein enormes Potenzial, um die derzeitigen Einschränkungen von CAR-T zu überwinden. CAR-T hat Probleme, geeignete und sichere Ziele für mehr als einige wenige Krebsarten zu finden“, sagte Professor Oliver Ottmann, Leiter der Abteilung für Hämatologie an der Universität Cardiff .
Studien an unheilbar kranken Patienten könnten bereits im November beginnen.
Möglicher Durchbruch: Forscher entdecken Viren, die JEDE Art von Krebs abtöten
Wissenschaftler haben ein neues Virus im Windpockenstil entwickelt, das im Kampf gegen Krebs ein enormes Potenzial aufweist. In Versuchen am Menschen wird man das Virus direkt in die Tumore injizieren, in der Hoffnung, dass es sich dort vermehrt und den Tumor zerstört.
Das Virus mit der Bezeichnung CF33 wurde von der australischen Firma Imugene entwickelt und hat bereits Erfolge bei der Bekämpfung sämtlicher Krebsarten in einer Petrischale gezeigt, während es die tatsächlichen Tumore bei Mäusen schrumpfte.
Die Behandlung wird von dem US-amerikanischen Krebsexperten Prof. Yuman Fong entwickelt, der hofft, dass die Erfolge bei Labortests an Mäusen zu einem ähnlichen Erfolg bei der Behandlung von Menschen führen könnten.
Imugene stellt laut Daily Telegraph auf Patienten mit dreifach negativem Brustkrebs, Melanom, Lungenkrebs, Blasen-, Magen- und Darmkrebs ab.
Dies ist nicht das erste Mal, dass ein Virus gegen Krebs eingesetzt wird. Tatsächlich zeigt die Fähigkeit von Viren, menschliche Zellen zu infizieren und abzutöten, einiges von ihrem Potenzial bei der Behandlung von Krebs.
Ein gentechnisch verändertes Herpesvirus wurde zur Behandlung von Hautkrebs und Windpocken selbst eingesetzt – ein Virus, das seinen Ursprung in Rindereutern hat. Es bildete die Grundlage für Pockenimpfstoffe zur Behandlung des Menschen.
Und jetzt werden Windpocken in CF33 zur Behandlung von Krebs eingesetzt.
Professor Fong sagte gegenüber dem Daily Telegraph:
„Es gab seit dem frühen 20. Jahrhundert Hinweise darauf, dass Viren womöglich Krebs töten können, wenn bei gegen Tollwut geimpften Menschen der Krebs verschwand und sie in eine Wiedergenesung übergingen.
Das Problem war nur, dass, wenn Sie das Virus so giftig machen, dass es Krebs zerstört, man befürchten muss, dass es auch den Menschen tötet.“
Fong hofft, dass seine neue Formel den Menschen helfen wird, Krebstumore erfolgreich zu bekämpfen.
In Versuchen am Menschen wird man das Virus direkt in die Tumore injizieren, in der Hoffnung, dass es sich dort vermehrt und den Tumor zerstört.
Experten raten jedoch zur Vorsicht, bevor die Behandlung von Fong etwa voreilig als ein wichtiger neuer Durchbruch gefeiert wird, die in naher Zukunft für den medizinischen Einsatz bereit sein könnte.
Prof. Sanchia Aranda, Vorsitzender des Krebsbeirats, erklärte dazu:
„Wenn es an einem Menschen getestet wird, werden wir sehen, ob das Immunsystem eine Abwehrfunktion gegen das Virus ausübt und es abschaltet, bevor es an den Krebs gelangt oder ob etwa schädliche Nebenwirkungen auftreten können.
Krebszellen sind sehr klug, sie sind echte Darwinisten, die mutieren, um zu überleben, und es besteht die Wahrscheinlichkeit, dass sie resistent gegen das Virus werden, wie sie es jetzt bereits tun, um resistent gegen Chemotherapie und Immuntherapie zu werden.“
Verweise:










